Ikatan Kimia (Ikatan Ion, Ikatan Logam, Ikatan Kovalen) – Pernah akan anda melihat sebuah kerikil yang besar? Batu tersebut tersusun dari butiran pasir yang sangat kecil yang terikat satu sama lain. Di dalam pasir tersebut juga tersusun partikel-patikel yang lebih kecil menyerupai silikon. Begitu pula dengan garam dapur, terdapat ion-ion natrium dan klorin yang membentuk ikatan sedemikian rupa. Bagaimana partikel-partikel ini sanggup bergabung?
Di alam, atom cenderung dalam keadaan stabil. Atom yang berada dalam kondisi stabil tidak gampang bereaksi, sebaliknya atom yang tidak stabil akan gampang membentuk ikatan untuk mencapai suatu kestabilan. Lewis pun berkesimpulan bahwa atom akan stabil kalau memenuhi kaidah duplet dan oktet menyerupai gas mulia. Kestabilan diperoleh dengan membentuk ion maupun pasangan elektron bersama.
Apa itu kaidah duplet atau oktet?
Perhatikanlah tabel konfigurasi atom gas mulia berikut ini.
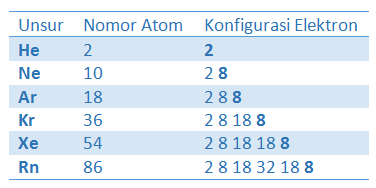
Tabel konfigurasi atom gas mulia
Perhatikanlah jumlah elektron terluar pada kolom konfigurasi elektron di atas. Menurut Lewis dan Kossel bahwa konfigurasi elektron akan stabil bila elektron terluarnya duplet (2) atau oktet (8). Sehingga untuk sanggup memenuhi hukum tersebut (kestabilan), maka terjadilah perpindahan elektron yang mencakup pelepasan elektron atau menangkap elektron.
Jenis-Jenis atau Macam-Macam Ikatan Kimia (Ikatan Ion, Ikatan Logam, Ikatan Kovalen)
1. Ikatan Ion
Ikatan ion ialah ikatan yang terbentuk alasannya ialah adanya gaya tarik menarik secara elektrostatis yang terjadi di antara ion konkret dan negatif.
Atom yang energi ionisasinya rendah akan gampang membentuk ion konkret alasannya ialah melepaskan elektron. Kemudian elektron tersebut ditangkap oleh atom yang mempunyai afinitas elektron yang besar membentuk ion negatif alasannya ialah ia gampang mendapatkan elektron. Sehingga akan terjadi gaya tarik menarik dan terbentuklah senyawa yang bersifat netral.
Perhatikanlah gambar ilustrasi di bawah ini
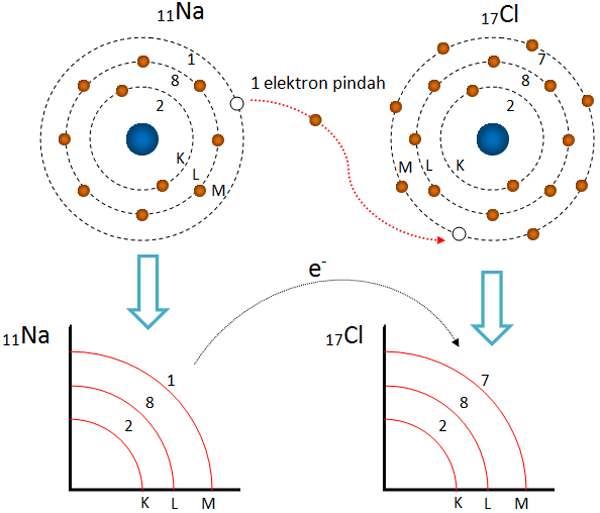
Ikatan ion pada senyawa NaCl
Bila ditulis memakai persamaan kimia menjadi menyerupai di bawah ini
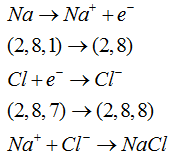
Di dalam senyawa, ion konkret dan negatif tersusun dalam jumlah tertentu. Sebagai teladan senyawa NaCl yang berbentuk kristal bersama-sama membentuk struktur kubus. Tiap-tiap ion Na+ dikelilingi oleh ion Cl– sejumlah 6 ion.
Beberapa sifat senyawa ion yaitu membentuk kristal namun rapuh, titik lebur dan titik lelehnya tinggi, gampang sekali larut dalam air, dan bisa menghantarkan arus listrik.
2. Ikatan Logam
Ikatan logam ialah ikatan kimia yang mempunyai ciri-ciri yaitu bisa menjadi penghantar panas maupun arus listrik, sanggup atau gampang ditempa, bersifat ulet, dan juga bisa diulur menjadi kawat. Pembentukan ikatan ion terjadi alasannya ialah adanya perbedaan energi ionisasi dan afinitas elektron suatu atom.
Ikatan logam terdiri dari ion logam yang konkret di lautan elektron yang merupakan valensi elektron dari setiap atom dan saling bertumpang tindih. Elektron-elektron tersebut bebas bergerak dan mengelilingi inti di dalam kristal. Elektron yang bisa bebas bergerak ini dikenal dengan sebutan elektron dislokasi. Sedangkan gaya tarik antar atom-atom mengakibatkan terjadinya ikatan logam.
Karena elektron-elektron di dalam logam sanggup bebas bergerak maka logam sanggup menghantarkan panas atau kalor dan arus listrik. Sehingga logam banyak dimanfaatkan dalam alat-alat listrik dan rumah tangga.
3. Ikatan Kovalen
Ikatan kovalen ialah ikatan yang terjadi alasannya ialah adanya pemakaian pasangan elektron secara bersama-sama. Namun kalau pasangan elektron yang digunakan bersama itu berasal dari salah satu atom, ikatan ini disebut sebagai ikatan kovalen koordinasi.
Sebagai teladan yaitu pada molekul hidrogen. Dalam molekul hidrogen terdapat dua atom hidrogen yang saling berikatan membentuk ikatan kovalen. Masing-masing atom hidrogen menyumbangkan 1 elektronnya sehingga membentuk pasangan elektron yang berikatan dan digunakan bersama-sama.
Ada banyak sekali senyawa yang merupakan ikatan kovalen contohnya O2, NH3, SO3, dan sebagainya. Di dalam senyawa kovalen juga ada bisa membentuk ikatan tunggal yang disebut sebagai ikatan kovalen tunggal. Lalu ada senyawa dengan ikatan rangkap dua yang disebut dengan ikatan kovalen rangkap dua. Selain itu terdapat juga ikatan kovalen rangkap tiga.
Dalam ikatan kovalen juga bisa terjadi penyimpangan kaidah oktet. Penyimpangan ini bisa terjadi pada senyawa BF3, CO, dan PCl5. Di dalam senyawa tersebut susunan elektron tidak duplet maupun oktet. Sehinggal mempunyai struktur yang berbeda dari senyawa yang lain.
Nah, ada pertanyaan terkait Ikatan Kimia (Ikatan Ion, Ikatan Logam, Ikatan Kovalen) ??, untuk pembahasan terkait ikatan Kovalen yang lebih lengkap akan kita bahas pada halaman berjudul jenis-jenis dan pembentukan ikatan kovalen.
Referensi :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.
Sumber https://www.siswapedia.com