Rumusrumus.com kali ini akan membahas perihal rumus tekanan osmosis yang mencakup dengan pengertian serta klarifikasi dan gambar osmosis terbalik serta teladan osmosis dan perbandingan antara osmosis dengan difusi, untuk lebih lengkapnya simak klarifikasi dibawah ini
Pengertian Osmosis
Osmosis ialah perpindahan molekul pelarut melalui selaput semipermiabel dari kepingan yang lebih encer ke kepingan yang lebih pekat atau dari kepingan yang konsentrasi pelarut tinggi ke konsentrasi pelarut (misalnya air) rendah.
Membran semipermeabel harus bisa dilewati oleh pelarut, tetapi tidak oleh zat terlarut, yang menjadikan gradien tekanan sepanjang membran.
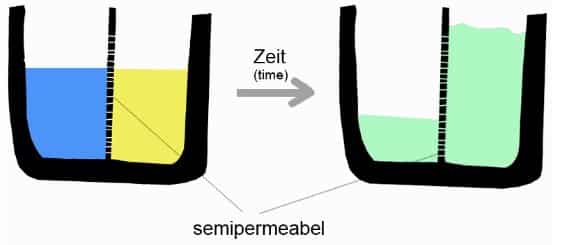
Osmosis merupakan suatu fenomena alami, tetapi bisa dihambat secara buatan dengan cara meningkatkan tekanan pada kepingan dengan konsentrasi pekat. Tekanan osmotik merupakan sifat koligatif, yang mempunyai arti bahwa sifat ini bergantung pada konsentrasi zat terlarut, dan bukan pada sifat zat terlarut itu sendiri.
Rumus Osmosis
Besarnya tekanan Osmosis larutan oleh Van’t Hoff, dinyatakan dengan rumus:
∏ = M R T
Keterangan Rumus :
∏ = tekanan osmotik larutan (atmosfir)
M = molaritas larutan (mol/L)
R = konstanta gas = 0,08205 L atm mol-1 K-1
T = suhu mutlak (°C + 273) K
Dalam hubungannya dengan konsentrasi larutan Van’t Hoff menyimpulkan bahwa tekanan osmosis larutan akan semakin besar kalau konsentrasi (Molar) dari zat terlarut semakin besar.
Faktor yang mensugesti Osmosis
- Suhu
Pergerakan molekul dipengaruhi pada suhu. Kadar resapan akan menjadi lebih cepat pada suhu yang tinggi dibandingkan dengan suhu yang rendah. - Ukuran molekul yang meresap
Molekul yang lebih kecil daripada garis pusat lubang membran akan meresap dengan mudah. - Ketebalan membran
Kadar resapan suatu molekul berkadar songsang dengan jarak yang harus dilaluinya. Berbanding dengan satu membran yang tebal, kadar resapan melalui satu membran yang tipis ialah lebih cepat. - Keterlarutan lipid
Molekul yang mempiliki keterlarutan yang tinggi meresap lebih cepat daripada molekul yang kelarutan yang rendah menyerupai lipid. - Luas permukaan membran
Kadar resapan menjadi cepat kalau luas permukaan membran yang disediakan untuk resapan yaitu lebih besar.
Proses Terjadinya Osmosis
Osmosis ialah proses alami. Saat dua cairan konsentrasi yang berbeda dipisahkan pada sebuah membran semipermeabel, cairan mempunyai kecenderungan untuk bergerak dari konsentrasi yang lebih rendah ke konsentrasi yang lebih tinggi untuk keseimbangan potensial kimia.
Secara formal, reverse osmosis yaitu proses memaksa pelarut dari kawasan konsentrasi zat terlarut tinggi melalui membran semipermeabel ke kawasan konsentrasi zat terlarut rendah dengan cara menerapkan tekanan melebihi tekanan osmotik.
Aplikasi terbesar dari reverse osmosis yaitu pemisahan air murni dari air bahari dan air payau, air bahari atau air payau bertekanan terhadap satu permukaan membran, mengakibatkan transportasi garam-menipis air melintasi membran dan munculnya air minum dari sisi tekanan rendah.
Membran yang digunakan untuk reverse osmosis mempunyai lapisan padat dalam matriks polimer – baik kulit membran asimetris ataupun lapisan interfasial dipolimerisasi dalam membran tipis-film-komposit – di mana pemisahan terjadi
Osmosis Terbalik
Osmosis terbalik (Reverse osmosis) ialah suatu metode penyaringan yang bisa menyaring banyak sekali molekul besar dan ion-ion dari suatu larutan dengan cara memberi tekanan pada larutan dikala larutan itu berada di salah satu sisi membran seleksi (lapisan penyaring).
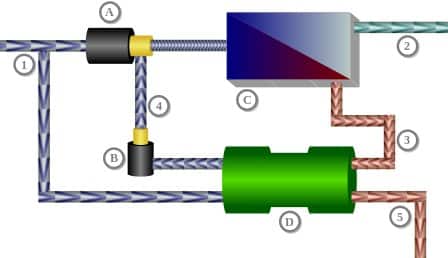
Skema osmosis terbalik (desalinasi) menggunakan pertukaran tekanan.
1 : Aliran masuk air laut,
2 : Aliran air higienis flow (40%),
3 : Aliran konsentrasi (60%),
4 : Aliran air bahari (60%),
5 : Konsentrat (pembuangan),
A : Aliran pompa tekanan tinggi (40%),
B : Pompa sirkulasi,
C : Satuan osmosis dengan membran,
D : Penukar tekanan
Proses itu menjadikan zat terlarut terendap di lapisan yang dialiri tekanan sehingga zat pelarut murni bisa mengalir ke lapisan berikutnya. Membran seleksi itu harus bersifat selektif yang artinya bisa dilewati zat pelarutnya (atau kepingan lebih kecil dari larutan) tetapi tidak bisa dilewati zat terlarut menyerupai molekul berukuran besar dan ion-ion.
Contoh Osmosis
- Tempatkan kentang dalam air murni, Kentang akan membengkak dari waktu ke waktu. Hal ini disebabkan lantaran adanya konsentrasi yang lebih tinggi dari pati dan zat terlarut lainnya dalam sel kentang daripada di dalam air, sehingga air mengalir ke dalam sel kentang secara osmosis.
- Sel akar tanaman mengambil air dari tanah melalui osmosis
Contoh Osmosis Pada Tubuh
- Garam dan mineral dari air ditransfer melalui osmosis. Air mengalir melalui membran plasma sel dan lantaran konsentrasi osmosis air, glukosa dan garam dipertahankan dalam tubuh. Kaprikornus filtrasi osmotik penting dalam mencegah kerusakan sel.
- Ikan air tawar menjaga keseimbangan cairan pada badan mereka melalui osmosis. Karena konsentrasi garam dalam badan ikan lebih tinggi dari air di sekitarnya, mereka tidak perlu minum air. Hal ini lantaran air impulsif diserap oleh hadir garam dalam badan mereka
Contoh Osmosis Pada Kehidupan Sehari-hari
- Ketika tangan kita karam pada cucian untuk waktu yang lama, kulit Akan terlihat membengkak. Ini ialah imbas dari osmosis.
- Ketika kita menuangkan garam ke siput, air berdifusi dan siput menyusut akhir osmosis.
- Ketika kita memasak masakan dan menaruh saus di kepingan cair dari piring Anda, beberapa kepingan dari zat terlarut bergerak pada kepingan padat dari masakan yang kita masak. Bagian padat bisa menjadi telur, sepotong daging tapi saus yang terbuat dari zat terlarut dan bukan air, sehingga akan pindah ke makanan.
Perbandingan Osmosis dan Difusi
- Osmosis terjadi dikala ada membran semi-permeable, membran ini tidak diharapkan untuk terjadinya difusi.
- Keduanya bisa terjadi lantaran adanya perbedaan konsentrasi.
- Pada osmosis yang berpindah yaitu molekul-molekul pelarut, biasanya air. Sedangkan pada difusi yang berpindah yaitu molekul-molekul terlarut.
- Difusi bisa menyebar hingga jarak yang jauh, sedangkan osmosis terbatas pada jarak yang lebih bersahabat saja.
- Pada proses difusi, molekul-molekul terlarut bergerak dari konsentrasi tinggi ke konsentrasi rendah, sedangkan pada osmosis molekul-molekul pelarut mengalir secara kebalikannya.
- Keduanya termasuk transpor pasif sehingga tidak memerlukan energi eksternal semoga kedua proses ini bisa terjadi.
- Difusi umumnya terjadi pada molekul-molekul gas, meski difusi juga bisa terjadi pada molekul padat-cair atau cair-gas.
- Osmosis hanya terjadi di antara dua larutan.
- Osmosis terjadi relatif lebih lambat kalau dibandingkan dengan difusi.
Demikianlah klarifikasi perihal osmosis, Semoga bermanfaat
Baca Juga :
Sumber https://rumusrumus.com