Rumusrumus.com kali ini akan membahas ihwal ilmu kimia fraksi mol, bukan hanya rumus fraksi mol saja, tetapi akan menjelaskan ihwal pengertian fraksi mol, serta relasi antara molalitas dengan molaritas dan juga menjelaskan ihwal relasi molalitas dengan persen massa secara detail. Sebagai suplemen akan di jelaskan juga ihwal pengertian normalitas beserta rumus normalitas
Pengertian Fraksi Mol
Fraksi mol adalah ukuran konsentrasi larutan yang menyatakan perbandingan jumlah mol sebagian zat terhadap jumlah mol total komponen larutan.
Fraksi mol juga sering disebut fraksi jumlah dan slalu identik dengan fraksi angka, yang digambarkan sebagai jumlah molekul suatu konstituen dibangi dengan jumlah total semua molekul. Konsep ini hanya merupakan salah satu cara menunjukkan adanya komposisi adonan dengan satuan tak berdimensi. Fraksi mol kadang kala dilambangkan dengan huruf Yunani daripada karakter Romawi.
Dalam perhitungan ilmu kimia banyaknya zat terlarut didalam pelarut disebut dengan konsentrasi. Konsentrasi larutan sangat perlu dihitung secara sempurna dengan cara memilih massa zat terlarut dan pelarut.
Konsentrasi larutan ini berupa molalitas, fraksi mol, molaritas dan persen massa. Adapun hal-hal tersebut akan dijelaskan satu persatu dan dilengkapi dengan rumus masing-masing. Berikut Rumusrumus.com akan menjelasannya.
Rumus Fraksi Mol
Molalitas ialah konsentrasi larutan yang menyatakan jumlah mol, zat terlarut dalam 1 kilogram atau 1000 gram pelarut. rumus molalitas yaitu sebagai berikut :
Jumlah mol zat pelarut / 1Kg zat pelarut
Fraksi mol zat terlarut (Xt) biasa dirumuskan dirumuskan dengan rumus menyerupai berikut ini:
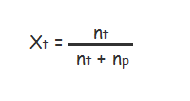
Keterangan :
- Xt : Fraksi mol zat terlarut
- Np : Jumlah mol zat pelarut
- Nt : Jumlah mol zat terlarut
Fraksi mol zat palarut (Xp) biasa dirumuskan dengan rumus menyerupai berikut ini:

Hubungan antara Molalitas dengan Persen massa
Persen massa ialah satuan konsentrasi yang juga sanggup dipakai didalam larutan kimia. Contohnya ialah larutan yang biasa kita jumpai sehari-hari yaitu larutan alkohol 75% dan larutan asam cuka 24%. Persen masa ialah jumlah gram zat yang terlarut dalam 100 gram massa larutan.
Persamaan yang menunjukkan perhitungan persen massa yaitu sebagai berikut :
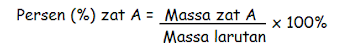
Hubungan antara Molalitas dengan Molaritas
Molaritas menyatakan sejumlah mol zat terlarut dalam satu liter larutan. Molaritas sanggup dikonversikan menjadi molalitas, caranya dengan merubah volume larutan menjadi massa larutan. Pengubahan volume menjadi massa diharapkan data massa jenis larutan yang sanggup dirumuskan sebagai berikut :
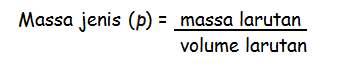
Normalitas ialah besaran yang menyatakan pada jumlah mol ekivalen zat terlarut didalam tiap satuan volume larutan. Satuan normalitas yaitu normal (N) yang sama dengan mol ekivalen/liter. Normalitas juga mempunyai rumus sebagai berikut :
N = ek/V atau N= n.a/V atau sanggup juga N = M x a
Keterangan :
ek yaitu mol ekivalen yakni jumlah mol dikalikan dengan jumlah ion H+ atau ion OH-
Meski sifat koligatif selalu melibatkan beberapa larutan, namun sifat koligatif tidak bergantung pada interaksi antara zat pelarut dan molekul pelarut , tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan . Sifat koligatif itu terdiri dari penurunan tekanan uap juga kenaikan titik didih serta penurunan titik beku, dan tekanan osmotik.
Molekul zat cair yang meninggalkan permukaan menjadikan adanya tekanan uap zat cair. Semakin gampang molekul – molekul zat cair itu berkembang menjadi uap, makin tinggi juga tekanan uap zat cair tersebut.
Namun Apabila tekanan zat cair tersebut dilarutkan pada zat terlarut yang tidak menguap, maka partikel – partikel zat terlarut akan mengurangi penguapan molekul zat cair.
Laut mati ialah misalnya dari insiden penurunan tekanan uap pelarut oleh zat terlarut yang tidak gampang menguap.
Contoh Soal Fraksi Mol
Agar lebih memahami ihwal pengertian dan rumus fraksi mol, maka sebaiknya berlatih soal yaitu hal yang paling ampuh, dibawah ini teladan – teladan soal fraksi mol lengkap dengan pembahasannya.
Contoh Soal 1
Sebuah larutan terdiri dari 3 mol zat A, 3 mol zat B, dan 4 mol zat C. Hitung fraksi mol dari masing – masing zat tersebut ?
Pembahasan :
Diketahui :
- nA = 3
- nB = 3
- nC = 4
Penyelesaian :
XA = nA / (nA + nB +nC)
XA = 3 / (3 + 3 + 4)
XA = 0.3
XA = nA / (nA + nB +nC)
XA = 3 / (3 + 3 + 4)
XA = 0.3
XA = nA / (nA + nB +nC)
XA = 4 / (3 + 3 + 4)
XA = 0.4
Jadi total dari XA + XB + XC = 0.3 + 0.3 + 0.4 = 1
Itulah pembahasan singkat ihwal materi dan rumus fraksi mol beserta teladan soalnya, agar bermanfaat..
Sumber https://rumusrumus.com