Rumusrumus.com pada kesempatan kali ini akan membahas wacana ilmu kimia laju reaksi, pengertian laju reaksi, rumus laju reaksi, pengaruh laju reaksi dan juga faktor laju reaksi
Pengertian Laju Reaksi
Laju reaksi ialah laju penurunan ( reaktan / pereaksi ) atau laju bertambahnya ( hasil reaksi / produk ). Laju reaksi ini menggambarkan cepat atau lambatnya suatu reaksi kimia, sedangkan reaksi kimia merupakan sebuah proses mengubah zat (pereaksi) menjadi zat yang gres dan disebut sebagai produk.
Contoh Reaksi Kimia
Beberapa reaksi kimia ada yang berlangsung sangat cepat. Natrium yang dimasukkan ke air akan mengatakan reaksi yang sangat cepat, contohnya dengan kembang api dan petasan yang disulut. Bensin akan gampang terbakar lebih cepat daripada minyak tanah.
tetapi, ada juga reaksi kimia yang berjalan lambat. contohnya : Proses pengaratan besi, membutuhkan waktu yang usang sehingga laju reaksinya disebut lambat. Cepat atau lambatnya sebuah proses reaksi kimia yang terjadi dinyatakan dengan laju reaksi.
Rumus Laju Reaksi
Laju reaksi kimia tak hanya sebuah teori, akan tetapi sanggup dirumuskan secara matematis
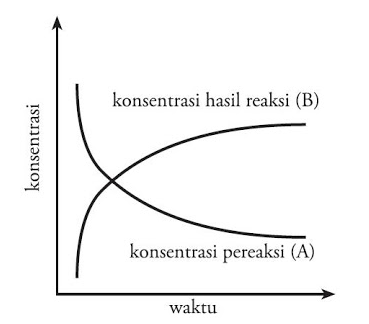
Pada reaksi kimia : A → B, maka laju berubahnya yaitu zat A menjadi zat B dan ditentukan dari hasil jumlah zat A yang bereaksi ataupun jumlah zat B yang terbentuk per satuan waktu
ketika pereaksi A berkurang, maka hasil reaksi B akan bertambah
Faktor Yang Mempengaruhi Laju Reaksi
Laju reaksi suatu reaksi kimia sanggup dipengaruhi oleh beberapa faktor, contohnya luas permukaan zat yang bereaksi, konsentrasi pereaksi, suhu pada ketika reaksi kimia terjadi, dan ada tidaknya katalis. Seiring dengan proses terjadinya reaksi kimia, maka ada satu hal yang harus dipelajari untuk memilih berjalan atau tidaknya sebuah reaksi kimia, yaitu tumbukan. Suatu reaksi kimia sanggup terjadi apabila ada tumbukan antara molekul zat-zat yang bereaksi. Tumbukan yang menghasilkan reaksi kimia hanya tumbukan yang efektif. Tumbukan yang efektif harus memenuhi dua syarat, yaitu posisinya yang sempurna dan energinya yang cukup.
Pengaruh Terhadap Laju Reaksi
Pengaruh konsentrasi pada laju reaksi
Jika konsentrasi salah satu larutan makin besar, larutan tersebut akan mengandung jumlah partikel yang semakin banyak sehingga partikel-partikel tersebut akan tersusun menjadi lebih rapat dibandingkan larutan yang konsentrasinya yang lebih rendah. Susunan partikel yang rapat memungkinkan terjadinya tumbukan semakin banyak dan kemungkinan terjadinya reaksi yang lebih besar. Makin besar suatu konsentrasi zat, maka makin cepat laju reaksinya.
pengaruh luas permukaan pada laju reaksi
ketika zat-zat pereaksi dicampur, akan terjadi tumbukan antar partikel pereaksi di permukaan zat. Laju reaksi bisa diperbesar dengan cara memperluas permukaan bidang sentuh zat yang dilakukan dengan memperkecil ukuran zat pereaksi
Pengaruh suhu terhadap laju reaksi
Partikel dalam zat yang selalu bergerak. Jika suhu zat itu dinaikkan, maka energi kinetik partikel akan bertambah ,sehingga tumbukan antar partikel akan mempunyai energi yang cukup untuk melampaui energi pengaktifan. Hal ibarat ini sanggup menjadikan lebih banyak terjadi tumbukan yang efektif
Pengaruh katalis pada laju reaksi
laju Reaksi yang berjalan lambat bisa dipercepat dengan cara memberi zat lain tanpa menambah konsentrasi ataupun suhu reaksi. Zat itu disebut katalis. Katalis bisa mempercepat laju reaksi, namu tidak mengalami perubahan kimia sehingga pada selesai reaksi zat itu sanggup diperoleh kembali.
Baca Juga :
Sumber https://rumusrumus.com