Reaksi Reduksi dan Oksidasi (Redoks) sering kita temukan dalam kehidupan sehari-hari contohnya pada reaksi pembakaran, pembuatan larutan cuka, reaksi metabolisme di dalam tubuh, dan lain sebagainya.
Reaksi reduksi dan oksidasi mengalami perkembangan sehingga bisa menjelaskan proses perubahan kimia dalam banyak sekali peristiwa.
Perkembangan Kosep Reaksi Redoks
Pada mulanya reaksi
oksidasi diartikan sebagai reaksi pengikatan oksigen oleh zat tertentu.
Sedangkan reaksi reduksi yaitu reaksi pelepasan oksigen. Contoh reaksinya
yaitu:
Oksidasi : H2(g) + ½ O2 (g) → H2 (l)
Reduksi : FeO (s) +
CO (g) → Fe (s) CO2 (g)
Namun pendapat tersebut dinilai kurang menjelaskan reaksi kimia secara luas alasannya yaitu banyak reaksi yang tidak melibatkan oksigen. Kemudian konsep redoks berkembang dimana reaksi oksidasi merupakan reaksi yang melibatkan pelepasan elektron dan reaksi reduksi yaitu reaksi yang melibatkan pengikatan elektron.
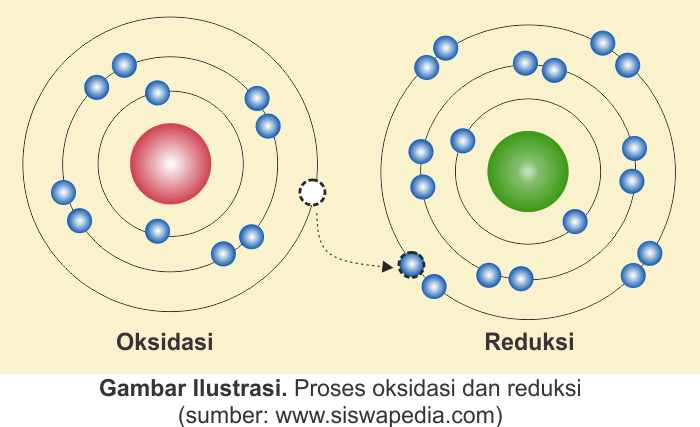
Konsep tersebut ditunjukkan oleh persamaan reaksi kimia berikut.
Na(s) + ½ Cl2
(g) → NaCl (s)
Reaksi di atas
melibatkan dua peristiwa:
Oksidasi : Na (s) → Na+ (s)
+ e–
Reduksi : ½ Cl2
(g) + e– → Cl– (s)
Konsep ini menjelaskan bahwa pengikatan dan pelepasan elektron terjadi secara bersamaan. Transfer elektron terjadi pada senyawa yang beriktan ion. Itu berarti konsep ini hanya sanggup menjelaskan reaksi yang melibatkan senyawa-senyawa ion tetapi tidak sanggup menjelaskan reaksi yang melibatkan senyawa kovalen.
Artikel terkait: Metode lumpur aktif sebagai aplikasi redoks
Konsep redoks
berkembang yang menghasilkan teori bahwa terdapat suatu bilangan yang disebut
dengan bilangan oksidasi.
Bilangan Oksidasi dalam Konsep Redoks
Bilangan oksidasi
adalah suatu bilangan bundar yang menyatakan tingkat oksidasi suatu unsur yang
membentuk senyawa. Bilangan oksidasi atau biloks sanggup ditentukan berdasarkan
ikatan dan struktur suatu zat. Bilangan tersebut merupakan muataan riil suatu
ion dalam suatu senyawa.
Pada senyawa kovalen, bilangan oksidasi ini merupakan skala tingkat keelektronegatifan masing-masing atom penyusun senyawa itu sendiri. Semakin tinggi elektronegatifan atom maka semakin berpengaruh daya tariknya terhadap pasangan elektron sehinga bernilai negatif.
Namun sebaliknya kalau keelektronegatifitas suatu atom lebih rendah maka nilainya semakin positif.
Adapun aturan
penentuan bilangan oksidasi yaitu sebagai berikut.
- Atom di golongan IA menyerupai Li,
Na, K, Rb, Cs, serta Fr selalu mempunyai biloks +1 - Pada golongan IIA menyerupai Be, Mg,
Ca, Sr, dan Ba, selalu memunyai biloks +2 - Untuk golongan IIIA menyerupai atom
B, Al, serta Ga selalu mempunyai biloks +3. - Atom hidrogen atau H umumnya didalam
senyawa mempunyai bioloks +1, kecuali untuk senyawa-senyawa hidrida logam. - Senyawa hidrida logam menyerupai LiH,
CaH2, NaH, dan seterusnya atom hidrogen mempunyai biloks -1. - Umumnya atom oksigen atau O
memiliki biloks -2, kecuali dalam senyawa-senyawa peroksida menyerupai H2O2,
Na2O2, dan lain sebagainya. - Pada senyawa peroksida tersebut
atom O mempunyai bilangan oksidasi bernilai +2.
Berikut Contoh Reaksi Redoks menurut Bilangan Oksidasi
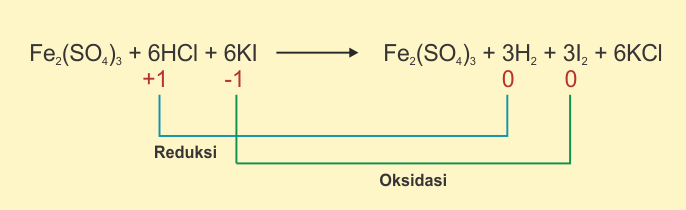
Perlu diingat bahwa
reaksi oksidasi yaitu reasi yang melibatkan kenaikan bilangan oksidasi.
Sedangkan reaksi reduksi yaitu reaksi yang diliputi oleh penurunan bilangan
oksidasi. Berikut beberapa contohnya.
Pengoksidasi dan Pereduksi
Didalam reaksi redoks
atau reaksi reduksi oksidasi, terdapat distributor pereduksi dan distributor pengoksidasi.
Pereduksi disebut juga reduktor, merupakan zat yang terlibat di dalam reaksi
redoks yang mengakibatkan zat lain mengalami reduksi. Sedangkan pengoksidasi atau
oksidator yang terdapat di dalam reaksi redoks akan menciptakan zat lain mengalami
oksidasi.
Dengan kata lain, zat reduktor akan mengalami oksidasi. Sedangkan zat oksidator akan mengalami reduksi. Pada pola reaksi di bawah ini,
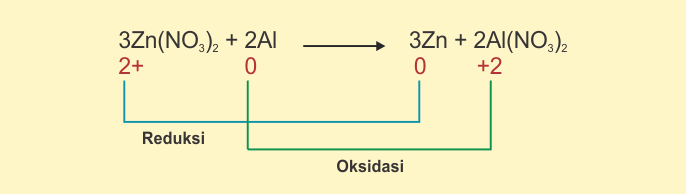
Zn(NO3)2
bertindak sebagai oksidator, maka senyawa ini mengalami reduksi. Sedangkan Al
bertindak sebagai reduktor sehingga mengalami oksidasi.
Sumber https://www.siswapedia.com