Atom Karbon dan Senyawa Karbon – Karbon yaitu suatu unsur yang paling banyak ditemukan di muka bumi. Bahkan unsur tersebut sanggup membentuk aneka macam senyawa yang berbeda.
Di dalam kerak bumi, unsur karbon
ditemukan dalam keadaan bebas maupun dalam bentuk senyawanya, khususnya berupa
mineral karbonat. Unsur karbon juga sanggup ditemukan di dalam badan makhluk
hidup yang kemudian disebut senyawa karbon organik.
Selain itu, karbon juga dapat
ditemukan dalam bentuk senyawa anrganik. Sebagai contoh, gas karbon dioksida
yang merupakan gas yang tidak beracun. Gas karbon dioksida salah satunya
dihasilkan dari hasil pembakaran dan pernafasan.
Allotrop Karbon
Karbon mempunyai tiga allotrop (bentuk-bentuk yang berbeda dan berasal dari satu unsur yang sama). Ketiga allotrop atom karbon yaitu grafit, intan, dan karbon amorf.
Grafit berwarna hitam dan gampang ringkih yang dibentuk melalui arang. Kegunaan grafit yaitu sebagai elektroda untuk baterai maupun elektrolisis. Sedangkan arang yaitu pola karbon yang stabil yang seringkali dipakai sebagai materi bakar.
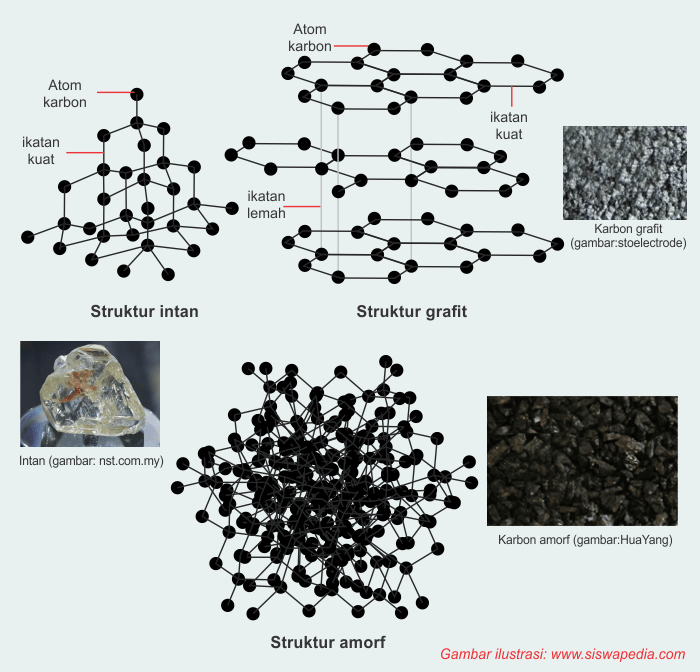
Intan merupakan bentuk lain dari
karbon, meski warnanya sama-sama kehitaman namun mempunyai struktur yang berbeda
dengan grafit. Intan banyak dipakai sebagai tambahan maupun sebagai pemotong
di bidang industri alasannya yaitu sifatnya yang keras. Karbon amorf sanggup ditemukan
pada kokas, debu karbon, arang tulang, maupun arang kayu.
Karbon banyak ditemukan di batu
bara, salah satu hasil tambang yang dipakai sebagai materi bakar. Melalui
proses destilasi kering, watu bara tersebut bisa dimurnikan sampai menjadi
kokas. Kokas biasanya dipakai sebagai reduktor pada pengolahan aneka macam macam
logam.
Kekhasan Atom Karbon yang Tidak
Dimiliki Unsur Lain
Atom karbon mempunyai beberapa sifat
khas yang dikenal dalam ilmu kimia. Beberapa sifat khas dari atom karbon adalah
sebagai berikut.
1. Dari tabel periodik unsur kita sanggup mengetahui bahwa atom karbon dengan lambang C mempunyai nomor atom dan jumlah elektron sebanyak 6. Itu artinya atom karbon mempunyai elektron valensi sebanyak 4. Keempat elektron valensi tersebut sanggup membentuk pasangan elektron bersama dengan atom-atom yang lainnya. Ikatan ini disebut dengan ikatan kovalen.
2. Keempat elektron valensi atom karbon sanggup membentuk rantai tersendiri. Sehingga akan dihasilkan banyak sekali kemungkinan terbentuknya senyawa-senyawa yang berbeda. Kemungkinan ini didasarkan pada jenis ikatan, jumlah ikatan, serta posisi atom karbon tersebut di dalam rantai karbon.
3. Karbon juga sanggup membentuk rantai lurus, bercabang, maupun siklik.
4. Selain itu karbon sanggup membentuk ikatan kovalen melalui ikatan tunggal dan ikatan rangkap.
Senyawa-senyawa Karbon
Karena unsur karbon mempunyai kemampuan untuk membentuk aneka macam senyawa yang berbeda. Untuk memudahkan pembelajaran ilmu kimia khususnya mengenai senyawa karbon, senyawa-senyawa tersebut dikelompokkan menurut gugus fungsi yang terikat pada karbon. Pada umumnya, senyawa ini disebut juga sebagai senyawa hidrokarbon.
Artikel terkait: Tata nama senyawa organik
Adapun pengelompokkan senyawa karbon
yaitu alkana, alkena, alkuna, eter, ester, asam karboksilat, alkohol, keton,
aldehid, dan haloalkana. Alkana, alkena, dan alkuna yaitu senyawa karbon yang
dibedakan menurut jenis ikatan (ikatan rangkap dan ikatan tunggal).
Senyawa akohol mempunyai gugus
hidroksil yaitu –OH. Sedangkan senyawa haloalkana mengikat atom halogen seperti
F, Cl, Br, dan I. Kemudian untuk senyawa eter, karbon mengikat oksigen sehingga
disebut dengan gugus alkoksi.
Selain itu, senyawa keton mengikat gugus karbonil begitu juga dengan aldehid. Perbedaannya adalah, pada keton, oksigen di apit oleh dua atau lebih karbon.
Sedangkan pada aldehid, gugus karbonil berada di ujung dari rantai karbon. Asam karboksilat mempunyai gugus fungsi –COOH sedangkan ester mempunyai gugus fungsi –COO-
Bila ada pertanyaan terkait artikel atom karbon dan senyawa karbon di atas, bisa ditulis di bawah ini.
Sumber :
Brady, J.E. (1999). Kimia Universitas: Asas dan Struktur jilid
1, Edisi ke 5. Terjemahan Sukmariah Maun, Karnianti Anas dan Tilda S.
Sally. Binarupa Aksara: Jakarta.
Sumber https://www.siswapedia.com