Faktor yang Mempengaruhi Laju Reaksi Kimia – Di dalam ilmu kimia kita seringkali mendengar istilah reaksi kimia. Reaksi kimia ialah proses perubahan zat pereaksi atau reaktan menjadi hasil reaksi atau produk secara kimia. Contoh reaksi kimia sanggup kita temukan pada proses perkaratan besi yang melibatkan gas oksigen.
Proses perkaratan besi tersebut sanggup berlangsung secara cepat ataupun lambat. Untuk mempercepat proses perkaratan, kita sanggup merendam besi di dalam air. Namun untuk memperlambat perkaratan, kita sanggup mengecat permukaan besi.
Dari sinilah sanggup dipahami bahwa terdapat suatu laju dari proses perkaratan tersebut. Selanjutnya akan dibahas mengenai laju reaksi kimia secara umum, khususnya faktor-faktor yang mempengaruhinya.
Baca juga: Penulisan persamaan reaksi kimia
Konsep Dasar Laju
Reaksi Kimia
Laju reaksi secara
umum sanggup diartikan sebagai pengurangan konsentrasi pereaksi maupun penambahan
konsentrasi hasil reaksi pada reaksi kimia per satuan waktu. Hal ini dapat
dipahami melalui persamaan berikut.
Reaksi : P -> R

r = laju reaksi
∆t = waktu yang diharapkan untuk bereaksi
∆[P] =
perubahan konsentrasi reaktan
∆[R] =
perubahan konsentrasi produk
Tanda negatif
menunjukkan bahwa konsentrasi reaktan (pereaksi) menurun terhadap waktu.
Sedangkan tanda faktual mengatakan bahwa konsentrasi produk bertambah terhadap
waktu. Hal ini ditunjukkan pada grafik di bawah ini.
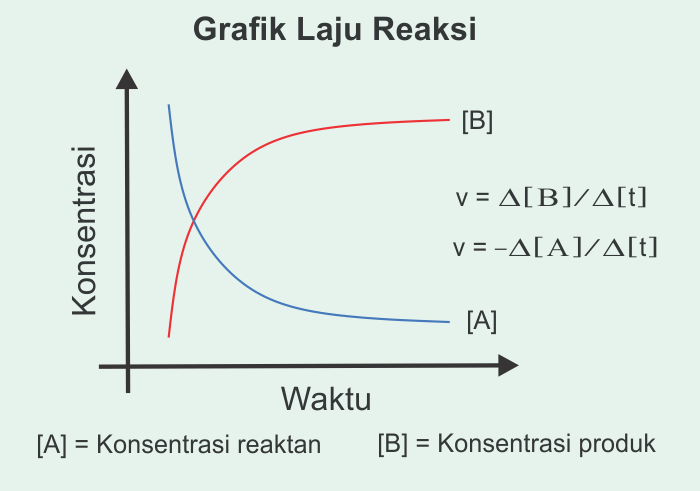
Faktor-faktor yang
Mempengaruhi Laju Reaksi Kimia
Laju reaksi dapat
dipercepat maupun diperlambat. Berikut beberapa faktor yang sanggup mempengaruhi
laju suatu reaksi kimia.
1) Sifat Zat yang Bereaksi
Reaktan yang mempunyai sifat yang berbeda akan bereaksi dengan laju yang berbeda pula. Hal ini disebabkan lantaran masing-masing zat mempunyai afinitas yang berbeda-beda. Umumnya, reaksi yang terjadi antara senyawa ion sanggup berlangsung cepat. Penyebabnya ialah gaya tarik-menarik yang berpengaruh antara ion-ion dengan muatan yang berlawanan.
Artikel terkait: Tata nama senyawa organik
Sedangkan untuk
reaksi yang terjadi antara senyawa kovalen pada umumnya mempunyai laju reaksi
yang lambat. Hal ini dikarenakan untuk memutus ikatan kovalen dibutuhkan energi
yang besar. Sebagai contoh, metana yang direaksikan dengan gas klor di ruangan
gelap akan menghasilkan gas trikloro metana dan gas asam klorida namun sangat
lambat.
2) Konsentrasi Zat Pereaksi (Reaktan)
Jika kita ingin
suatu reaksi kimia berjalan lebih cepat, kita sanggup menambahkan konsentrasi zat
pereaksi atau reaktan. Namun bila konsentrasi reaktan diperkecil, maka laju
akan berkembang menjadi lambat.
3) Luas Permukaan
Dalam eksperimen
kimia telah dibuktikan bahwa luas permukaan zat sanggup mempengaruhi laju reaksi.
Zat yang berbentuk serbuk mempunyai laju yang lebih cepat daripada zat yang
berbentuk bongkahan apabila direaksikan dengan pereaksi yang sama.
4) Suhu
Suhu juga menjadi efek penting dalam reaksi kimia. Jika kita meningkatkan suhu, maka reaksi kimia akan berjalan lebih cepat. Contoh sederhana sanggup kita lihat sehari-hari yaitu dikala menyimpan masakan di dalam lemari es, masakan tersebut akan bertahan lebih usang daripada masakan yang diletakkan di suhu ruangan. Hal ini lantaran suhu ruangan lebih tinggi daripada suhu di dalam lemari pendingin.
Artikel terkait: Tata nama senyawa anorganik
5) Tekanan
Faktor tekanan
dapat mempengaruhi laju reaksi pada zat yang berwujud gas. Hal ini dikarenakan
apabila tekanan dinaikkan, maka volume akan diperkecil sehingga menaikkan
konsentrasi. Itu artinya, laju reaksi akan meningkat.
6) Katalis
Cara lain untuk
mempercepat reaksi ialah dengan menambahkan katalis pada reaksi kimia. Katalis
adalah zat yang fungsinya hanya mempercepat laju reaksi namun tidak bereaksi
dengan reaktan. Dengan kata lain, katalis tidak merubah hasil reaksi, namun
hanya mempercepat proses pembentukan zat produk atau hasil.
Sumber :
Atkins, P.W. (1990). Physical Chemistry 4th Ed. USA: W.H. Freeman and Co.
Benny Karyadi.
(1996). Kimia 2. Jakarta: Balai
Pustaka.
Sumber https://www.siswapedia.com