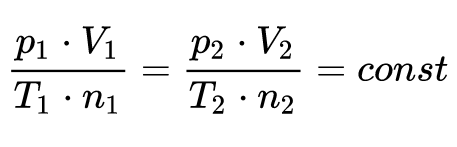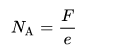Rumusrumus.com kali ini akan membahas wacana aturan avogadro, yaitu rumus aturan avogadro, pengertian wacana bilangan avogrado, dan juga sejarah ketetapan avogrado
Pengertian Hukum Avogadro
Hukum Avogadro ( Prinsip Avogadro, atau Hipotes Avogadro) ialah aturan gas sesuai dengan ilmuwan Italia Amedeo Avogadro, yang pada tahun 1811 mengajukan hipotesis sebenarnya Gas-gas yang mempunyai volume yang sama,tekanan yang sama dan pada temperatur yang sama , mempunyai jumlah partikel yang sama pula.
Artinya, jumlah molekul ataupun atom pada suatu volum gas tidak bergantung pada ukuran atau massa dari molekul gas tersebut. Sebagai contoh, 1 liter gas hidrogen dan nitrogen sanggup mengandung jumlah molekul yang sama, selama suhu dan tekanannya pun sama. Aspek ini sanggup dinyatakan secara matematis

Rumus Hukum Avogadro
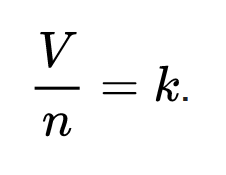
Pengertian :
V ialah volum gas.
n ialah jumlah mol pada gas tersebut.
k ialah tetapan kesebandingan.
Akibat penting dari aturan tersebut ialah bahwa Konstanta gas ideal mempunyai nilai yang sama bagi semua gas. Artinya, konstanta
Pengertian :
p idalah tekanan gas
T idalah temperatur
memiliki nilai yang sama pada semua gas, tidak bergantung pada ukuran ataupun massa molekul gas. Hipotesis Avogadro dibuktikan melalui teori kinetika gas.
Satu mol pada gas ideal mempunyai volum 22.4 liter pada kondisi standar (STP), angka ini sering juga disebut volum molar gas ideal. Gas-gas kasatmata (non-ideal) mempunyai nilai yang berbeda.
Bilangan Avogadro (lambang: L, atau NA), juga disebut sebagai ketetapan Avogadro ataupun konstanta Avogadro, ialah banyaknya “entitas” (biasanya atom ataupun molekul) di dalam satu mol , yang juga merupakan jumlah atom karbon-12 dalam 12 gram (0,012 kilogram) karbon-12 dalam keadaan dasarnya. Perkiraan terbaik terakhir untuk angka ini ialah :
![]() Nilai ini sangat akrab (hanya berbeda 0.37% lebih kecil) daripada 279 mol−1, sehingga angka ini juga mempunyai kegunaan sebagai asumsi pada fisika nuklir pada ketika menghitung laju pertumbuhan reaksi berantai.
Nilai ini sangat akrab (hanya berbeda 0.37% lebih kecil) daripada 279 mol−1, sehingga angka ini juga mempunyai kegunaan sebagai asumsi pada fisika nuklir pada ketika menghitung laju pertumbuhan reaksi berantai.
Sejarah Hukum Avogadro
Konstanta Avogadro dinamakan berdasarkan seseorang ilmuwan berkebangsaan Italia dari awal kurun ke-19, Amedeo Avogadro, yang pada tahun 1811 untuk pertama kalinya mengemukakan sebenarnya volume suatu gas (pada tekanan dan suhu tertentu) itu berbanding lurus dengan jumlah atom ataupun molekul tanpa bergantung dari jenis gas.dan Fisikawan Perancis, Jean Perrin, pada tahun 1909 memberi seruan nama konstanta ini untuk menghormati Avogadro. Perrin pun mendapat penghargaan pada Nobel Prize in Physics tahun 1926, terutama sebab karyanya di dalam memilih bilangan Avogadro dengan beberapa metode.
Nilai bilangan Avogadro ini untuk pertama kalinya diperkirakan oleh Johann Josef Loschmidt, yang pada tahun 1865 menghitung diameter rata-rata molekul di udara dengan metode yang sama dan dengan menghitung jumlah partikel di dalam sebuah volume gas tertentu dalam keadaan standar, kini disebut ketetapan konstansta loschmidt untuk menghormatinya
, dan terkait dengan bilangan Avogadro, NA, melalui persamaan: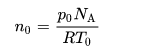
- po ialah tekanan
- R ialah konstanta gas
- To ialah suhu mutlak
Hubungan dengan Loschmidt ialah akar dari lambang L yang sering dipakai pada bilangan Avogadro constant, dan kepustakaan bahasa Jerman sanggup merujuk kedua konstanta ini dengan nama yang sama, bedanya hanya dari satuan ukurannya
Metode akurat paling pertama untuk mengukur bilangan Avogadro didasari pada metode coulometry. Prinsipnya ialah pengukuran konstanta Faraday (F) yaitu muatan listrik yang dibawa pada satu mol elektron, dan dibagi dengan muatan elementer (e) untuk mendapat bilangan Avogadro.
Baca Juga :
Sumber https://rumusrumus.com