Teori Atom dan Mekanika Kuantum – Setelah model atom berkembang, muncul teori gres yang berjulukan mekanika kuantum. Teori ini lebih kompleks dan detail dalam menjelaskan posisi elektron dan energinya. Di dalam teori ini kita akan memahami mekanika kuantum, radiasi elektromagnetik, model atom, dan orbital.
Mekanika Kuantum
Sifat-sifat atom sanggup dijelaskan oleh Max Planc dalam teorinya yang sangat populer yaitu teori kuantum atau mekanika kuantum. Sebelum itu terlebih dahulu kita harus memahami teori wacana gelombang. Getaran yang merambat disebut dengan gelombang. Jika sanggup merambat artinya energi bisa diteruskan. Kecepatannya bergantung pada jenis maupun sifat medium perambatan.
Kecepatan gemlombang juga dipengarhui oleh panjang gelombang, frekuensi, dan amplitudo. Terdapat korelasi antara panjang gelombang dengan frekuensi yaitu kecepatan merupakan hasil perkalian dari panjang gelombang dengan frekuensi.
Radiasi Elektromagnetik
Radiasi elektromagnetik sanggup bergerak melalui ruang hampa dengan kecepatan cahaya (300.000 km/s). namun kecepatan ini bisa berubah jikalau medium diubah. Gelombang menyerupai sinar matahari, sinar X, dan gelombang radio merupakan referensi gelombang elektromagnetik. Panjang gelombang juga bervariasi. Gelombang yang dipancarkan atom atau molekul ialah gelombang yang pendek.
Jika suatu unsur dipanaskan maka akan memancar cahaya dengan warna yang berbeda-beda. Oleh alasannya ialah itu didapatkan bahwa setiap unsur menghasilkan gelombang elektromagnetik dengan panjang gelombang tertentu. berbeda dengan matahari yang menghasilkan spektrum lengkap (kontinu). Spektrum yang dihasilkan dari atom hanya berupa spektrum garis yang dihasilkan alasannya ialah atom memancarkan radiasi elektromagnetik.
Menurut Planc, atom hanya menyerap maupun memancarkan energi dalam paket tertentu yang disebut dengan ‘kuanta’, sedangkan ‘kuantum’ ialah paket gelombang terkecil yang bisa diserap oleh atom. Disinilah hasilnya lahir teori mekanika kuantum yang dinyatakan dengan rumus :
E=hf
E ialah energi, h ialah tetapan Planck (6,626 × 10–34 J.s), dan f ialah frekuensi.
Teori niels Bohr juga digunakan, menurutnya, spektrum dihasilkan alasannya ialah elektron berpindah dari kulit yang berenergi rendah ke energi yang lebih tinggi yang disebut dengan eksitasi. Namun kelemahan teori Bohr ialah ia hanya sanggup menjelaskan spektrum atom-atom kecil menyerupai hidrogen dan gagal menjelaskan spektrum atom yang mempunyai elektron banyak (Baca: Partikel Penyusun Atom).
Gambar. Beberapa tokoh yang berjasa dalam penelitian atom (Sumber: www.britannica.com)
Model Atom Mekanika Gelombang
Menurut Louis de Broglie, materi sanggup bersifat sebagai partikel dan gelombang (sifat dualisme). Karena sifat dualisme ini, maka letak maupun kecepatan elektron tidak bisa dipastikan. Keadaan inipun dikenal dengan istilah prinsip ketidapastian Heisenberg. Kemudian diketahui bahwa lintasan elektron bukan melingkar menyerupai yang digambarkan Niels Bohr namun mengikuti pola gelombang yang diam.
Seorang ilmuan dari Austria berjulukan Schrödinger menciptakan perhitungan matematika untuk menjelaskan lintasan elektron atau orbital. Kemudian dihasilkan 3 bilangan yang bisa mendeskripsikan orbital elektron menjadi lebih jelas.
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama dipakai untuk memilih besarnya tingkat energi elektron yang dipakai untuk mencirikan ukuran orbital. Didapatkan bahwa bilangan n ini ialah bilangan lingkaran dari 1 sampai tidak terhingga. Misalnya n=1, maka terletak di kulit K, n=2 maka terletak di kulit L, n=3 maka terletak di kulit M.
2. Bilangan Kuantum Azimut (l)
Bilangan ini disebut juga sebagai momentum sudut yang bisa memberi gosip wacana bagaimana bentuk orbital. Nilainya tergantung pada nilai kunatum utama (n). Nilai n tertentu akan menghasilakan bilangan l dari nol hinga n-1.
Misalnya n=1 menjadi 1-1=0, subkulit ini dilampangkan dengan abjad s. Sedangkan n=2 menjadi 2-1=1, subkulit ini dilambangkan dengan abjad p. Jika n=3 menjadi 3-1=2, subkulit ini dilambangkan dengan abjad d. Dan jikalau n=4 menjadi 4-1=3, subkulit ini dilambangkan dengan abjad d.
3. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik sanggup memilih arah orientasi dari suatu orbital di dalam sebuah ruang, dan relatif terhadap orbital lainnya. Bilangan ini sanggup ditunjukkan dengan meletakkan spektrum garis suatu atom tertentu ke dalam medan magnet kemudian menghasilkan spektrum tambahan.
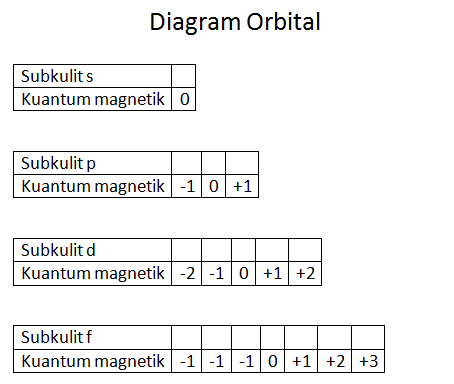
4. Bilangan Kuantum Spin (s)
Bilangan kuantum spin ialah bilangan kuantum yang tidak terpengaruh momentum sudut. Nilai bilangan kuantum spin yaitu +1/2 atau -1/2.
Baca lanjutan artikel di atas berjudul Konfigurasi Elektron.
Referensi :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.
Sumber https://www.siswapedia.com